Distribuição Eletronica Dos Elementos Quimicos Da Tabela Periodica Exemplo Cromo – Distribuição Eletrônica Dos Elementos Quimicos Da Tabela Periodica Exemplo Cromo nos leva a uma jornada fascinante pela estrutura atômica e suas implicações nas propriedades químicas dos elementos. Ao desvendar a organização dos elétrons nos átomos, podemos compreender como esses elementos se comportam em reações químicas, formando ligações e dando origem a compostos com propriedades únicas.
O cromo, em particular, apresenta uma configuração eletrônica peculiar que o torna um elemento de grande interesse, tanto na química quanto em diversas áreas da ciência e tecnologia.
A distribuição eletrônica, ou seja, a maneira como os elétrons estão organizados em torno do núcleo atômico, é um conceito fundamental para entender a natureza dos elementos. Ela determina a reatividade, a capacidade de formar ligações químicas e, consequentemente, as propriedades físicas e químicas de um elemento.
Para determinar a distribuição eletrônica, utilizamos o diagrama de níveis de energia, onde os elétrons ocupam diferentes níveis e subníveis de energia, seguindo princípios como o princípio de Aufbau, a regra de Hund e o princípio da exclusão de Pauli.
Introdução à Distribuição Eletrônica
A distribuição eletrônica é um conceito fundamental em química que nos permite entender as propriedades químicas dos elementos. Ela descreve como os elétrons estão organizados nos átomos, revelando informações cruciais sobre sua reatividade, formação de ligações químicas e comportamento em reações.
Níveis e Subníveis de Energia
O modelo atômico moderno descreve os elétrons como ocupando níveis de energia discretos ao redor do núcleo. Cada nível de energia é subdividido em subníveis de energia, que são representados por letras: s, p, d e f. Os subníveis possuem diferentes formas e energias, influenciando a distribuição dos elétrons.
Princípios da Distribuição Eletrônica

- Princípio de Aufbau:Os elétrons preenchem os níveis e subníveis de energia em ordem crescente de energia.
- Regra de Hund:Os elétrons preenchem os orbitais de um mesmo subnível individualmente, com spins paralelos, antes de começar a emparelhar-se.
- Princípio da Exclusão de Pauli:Cada orbital atômico pode acomodar no máximo dois elétrons, com spins opostos.
Distribuição Eletrônica do Cromo
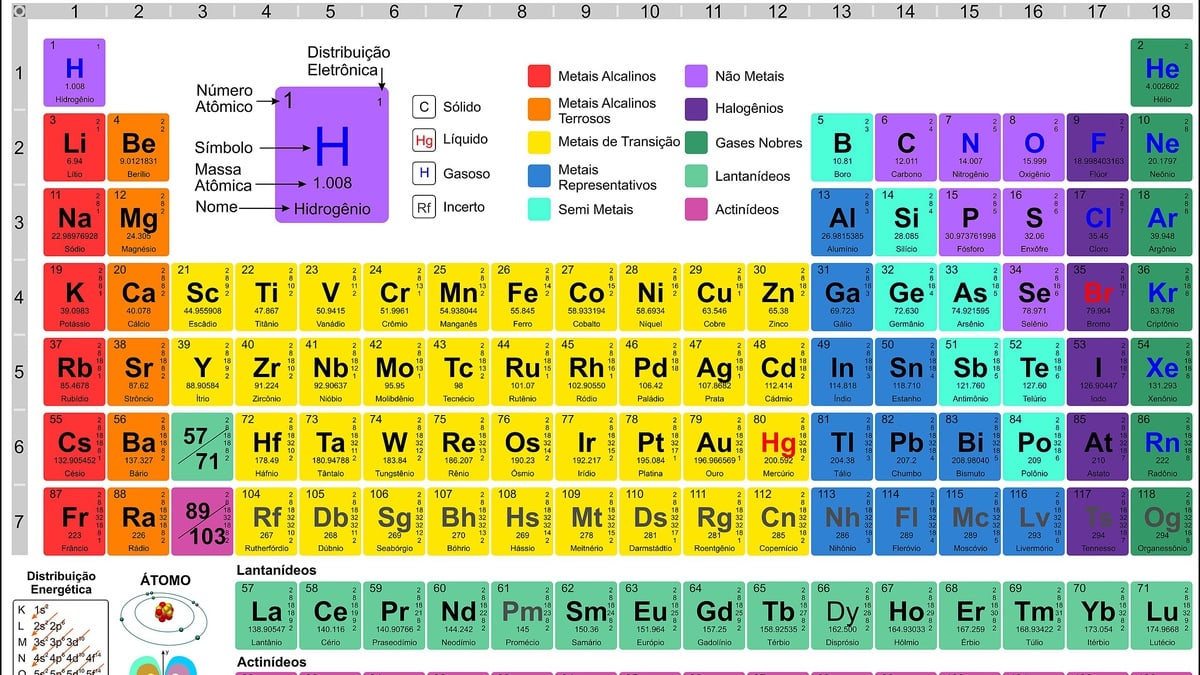
O cromo (Cr) é um elemento de transição localizado no grupo 6 da tabela periódica. Sua configuração eletrônica no estado fundamental apresenta uma exceção à regra de Hund, o que o torna um elemento interessante para estudarmos.
Configuração Eletrônica do Cromo
A configuração eletrônica do cromo é [Ar] 3d54s 1. De acordo com a regra de Hund, a configuração esperada seria [Ar] 3d 44s 2. No entanto, a configuração real do cromo demonstra uma exceção, com um elétron do subnível 4s “saltando” para o subnível 3d, resultando em um subnível 3d completamente preenchido e um subnível 4s com apenas um elétron.
Exceção à Regra de Hund
A exceção à regra de Hund no cromo é explicada pela maior estabilidade do átomo quando o subnível 3d está completamente preenchido. A configuração com 3d 54s 1proporciona uma maior estabilidade devido à simetria e ao menor número de elétrons desemparelhados.
Comparação com Outros Elementos do Grupo 6
Comparando a configuração eletrônica do cromo com outros elementos do grupo 6, como o molibdênio (Mo) e o tungstênio (W), podemos observar que a exceção à regra de Hund se repete. Isso indica uma tendência comum entre os elementos de transição de preferirem configurações eletrônicas com subníveis d completamente preenchidos ou meio preenchidos, devido à maior estabilidade.
Propriedades Químicas do Cromo
A distribuição eletrônica do cromo influencia significativamente suas propriedades químicas, como a reatividade, a formação de íons e a capacidade de formar ligações químicas.
Reatividade e Formação de Íons
O cromo é um metal relativamente inerte, mas pode formar íons com diferentes estados de oxidação. A configuração eletrônica 3d 54s 1do cromo permite que ele perca um ou dois elétrons do subnível 4s, formando íons Cr 2+ou Cr 3+, respectivamente.
Íons Cromo
- Cr2+: O íon cromo (II) é relativamente instável e facilmente oxidado a Cr 3+.
- Cr3+: O íon cromo (III) é mais estável e é encontrado em muitos compostos. Ele possui uma configuração eletrônica 3d 3, o que lhe confere propriedades magnéticas e cor características.
Compostos de Cromo
O cromo forma uma variedade de compostos com diferentes aplicações. Alguns exemplos incluem:
- Óxido de cromo (III) (Cr2O 3): Utilizado como pigmento verde em tintas e cerâmica.
- Cromato de chumbo (PbCrO4): Utilizado como pigmento amarelo em tintas e plásticos.
- Dicromato de potássio (K2Cr 2O 7): Utilizado como oxidante em reações químicas e na fabricação de corantes.
Representação da Distribuição Eletrônica
A distribuição eletrônica do cromo pode ser representada de diferentes maneiras, cada uma com suas vantagens e aplicações específicas.
Diagrama de Orbital
O diagrama de orbital mostra a distribuição dos elétrons em cada orbital atômico. Para o cromo, o diagrama de orbital seria:
s22s 22p 63s 23p 63d 54s 1
Tabela HTML
| Nível de Energia | Subnível | Número de Elétrons | Configuração |
|---|---|---|---|
| 1 | s | 2 | 1s2 |
| 2 | s | 2 | 2s2 |
| 2 | p | 6 | 2p6 |
| 3 | s | 2 | 3s2 |
| 3 | p | 6 | 3p6 |
| 3 | d | 5 | 3d5 |
| 4 | s | 1 | 4s1 |
Notação de Configuração Eletrônica
A notação de configuração eletrônica é uma maneira concisa de representar a distribuição eletrônica de um átomo. Para o cromo, a configuração eletrônica é [Ar] 3d 54s 1.
Aplicações da Distribuição Eletrônica
O conhecimento da distribuição eletrônica do cromo é fundamental para o desenvolvimento de tecnologias e materiais com propriedades específicas.
Aplicações do Cromo
- Metalurgia:O cromo é usado na produção de aço inoxidável, conferindo resistência à corrosão e ao calor.
- Química:Os compostos de cromo são utilizados como catalisadores em reações químicas, como a produção de ácido acético.
- Medicina:Alguns compostos de cromo são usados como suplementos nutricionais, enquanto outros são utilizados no tratamento de diabetes.
Propriedades Catalíticas
A distribuição eletrônica do cromo influencia suas propriedades catalíticas. Os elétrons desemparelhados no subnível 3d do cromo permitem que ele interaja com moléculas reagentes, facilitando a formação de ligações e a quebra de ligações, acelerando assim as reações químicas.
A distribuição eletrônica do cromo nos revela a natureza peculiar desse elemento, que se destaca por sua configuração eletrônica, influenciando suas propriedades químicas e abrindo portas para diversas aplicações. O cromo, com sua capacidade de formar diferentes íons e sua participação em compostos com propriedades únicas, desempenha um papel crucial em áreas como metalurgia, química e medicina.
A compreensão da distribuição eletrônica é fundamental para o desenvolvimento de novas tecnologias e materiais, explorando as propriedades do cromo e suas aplicações em diferentes campos da ciência e da indústria.
Quick FAQs: Distribuição Eletronica Dos Elementos Quimicos Da Tabela Periodica Exemplo Cromo
Quais são as principais diferenças entre a distribuição eletrônica do cromo e de outros elementos do grupo 6 da tabela periódica?
O cromo apresenta uma exceção à regra de Hund, com um elétron no subnível 4s e cinco elétrons no subnível 3d, ao contrário dos outros elementos do grupo 6, que geralmente têm dois elétrons no subnível 4s e quatro no subnível 3d.
Essa diferença se deve à maior estabilidade da configuração eletrônica com metade dos orbitais d preenchidos.
Quais são as principais aplicações do cromo na indústria?
O cromo é amplamente utilizado na metalurgia, como componente de aços inoxidáveis, conferindo resistência à corrosão e ao calor. É também utilizado em revestimentos, como o cromo duro, que oferece alta resistência ao desgaste e ao atrito. Além disso, o cromo é utilizado na produção de pigmentos para tintas e na fabricação de baterias.

