Assinale a Alternativa que Contém Exemplo de Soluções apresenta uma jornada abrangente no fascinante mundo das soluções, explorando seus conceitos fundamentais, propriedades, tipos e aplicações práticas. Mergulhe nesta análise aprofundada para ampliar seus conhecimentos e apreciar a importância das soluções em diversos aspectos de nossas vidas.
Neste artigo, desvendaremos o conceito de soluções em química, examinaremos seus tipos e propriedades, aprenderemos a calcular sua concentração e descobriremos as técnicas para prepará-las com precisão. Além disso, exploraremos as aplicações abrangentes das soluções em vários campos, destacando seu impacto significativo na sociedade.
Definição de Soluções: Assinale A Alternativa Que Contém Exemplo De Soluções

Uma solução é uma mistura homogênea de duas ou mais substâncias. O soluto é a substância presente em menor quantidade e o solvente é a substância presente em maior quantidade.As soluções são importantes em muitos processos químicos e biológicos. Elas podem ser usadas para dissolver sólidos, líquidos ou gases.
As soluções também podem ser usadas para conduzir eletricidade ou calor.As propriedades das soluções dependem da natureza do soluto e do solvente. Algumas soluções são ácidas, enquanto outras são básicas. Algumas soluções são condutoras de eletricidade, enquanto outras são isolantes.
Sub-tópico: Exemplos de Soluções
Existem muitos exemplos de soluções na vida cotidiana. Alguns exemplos incluem:
- Água salgada é uma solução de sal em água.
- Suco de laranja é uma solução de açúcar, água e outros nutrientes em água.
- Ar é uma solução de nitrogênio, oxigênio e outros gases.
Tipos de Soluções
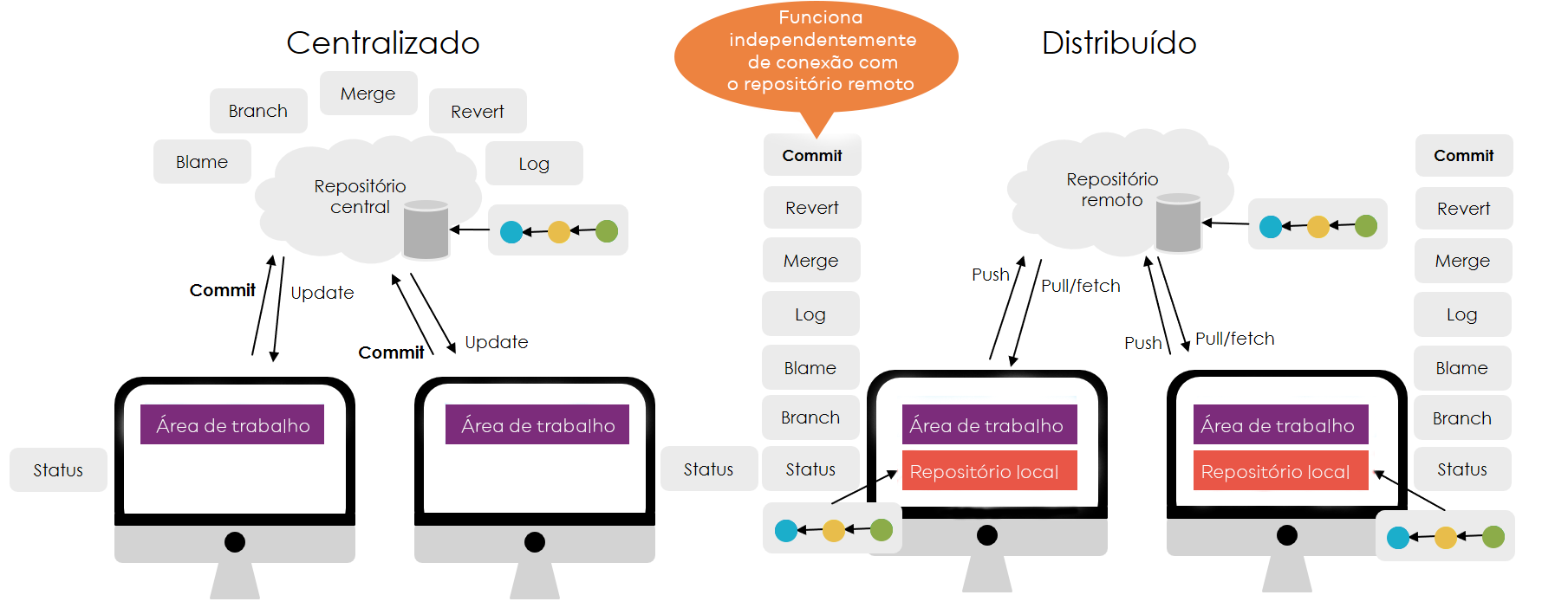
As soluções são classificadas em diferentes tipos com base na quantidade de soluto dissolvido no solvente. Esses tipos incluem soluções saturadas, insaturadas e supersaturadas.
Soluções Saturadas
Uma solução saturada é aquela que contém a quantidade máxima de soluto que pode ser dissolvida em um determinado solvente a uma temperatura específica. A adição de mais soluto não resultará em sua dissolução adicional.
Soluções Insaturadas
Uma solução insaturada contém menos soluto do que o necessário para atingir o estado de saturação. A adição de mais soluto resultará em sua dissolução até que a solução fique saturada.
Soluções Supersaturadas
Uma solução supersaturada é aquela que contém mais soluto do que o normalmente permitido pela temperatura e pressão dadas. É um estado metaestável que pode ser alcançado por meio de métodos especiais, como resfriamento rápido ou agitação constante.
Fatores que Afetam a Solubilidade
A solubilidade de um soluto em um solvente é influenciada por vários fatores, incluindo:
- Natureza do soluto e do solvente
- Temperatura
- Pressão (para soluções gasosas)
Concentração de Soluções

A concentração de uma solução é uma medida da quantidade de soluto dissolvido em uma quantidade determinada de solvente ou solução. Ela é importante para determinar as propriedades da solução e para realizar cálculos envolvendo reações químicas.
Existem diferentes unidades de concentração, cada uma com suas vantagens e desvantagens. As unidades mais comuns são:
- Molaridade (M): Número de mols de soluto por litro de solução.
- Molalidade (m): Número de mols de soluto por quilograma de solvente.
- Fração molar (X): Número de mols de soluto dividido pelo número total de mols na solução.
- Porcentagem em massa (% m/m): Massa de soluto em gramas por 100 gramas de solução.
- Porcentagem em volume (% v/v): Volume de soluto em mililitros por 100 mililitros de solução.
Cálculo da Concentração
A concentração de uma solução pode ser calculada usando a seguinte fórmula:
Concentração = Quantidade de soluto / Quantidade de solução
Onde:
- Quantidade de soluto pode ser expressa em mols, gramas ou mililitros.
- Quantidade de solução pode ser expressa em litros, quilogramas ou mililitros.
Conversão entre Unidades de Concentração
As diferentes unidades de concentração podem ser convertidas entre si usando fatores de conversão. Por exemplo, para converter molaridade em molalidade, multiplica-se a molaridade pela densidade do solvente.
Preparação de Soluções
A preparação de soluções envolve a dissolução de uma quantidade conhecida de soluto em um solvente para obter uma mistura homogênea com propriedades específicas.
Equipamentos Necessários
- Balança analítica
- Proveta ou pipeta graduada
- Béquer ou frasco volumétrico
- Bastão de vidro ou agitador magnético
- Funil
- Papel filtro (opcional)
Tabela de Instruções
| Passo | Procedimento |
|---|---|
| 1 | Calcular a massa de soluto necessária usando a fórmula: Massa de soluto = Concentração desejada × Volume da solução |
| 2 | Pesar a massa calculada de soluto usando uma balança analítica |
| 3 | Transferir o soluto para um béquer ou frasco volumétrico |
| 4 | Adicionar uma pequena quantidade de solvente e dissolver o soluto |
| 5 | Enxaguar o recipiente de pesagem com solvente e adicioná-lo ao béquer |
| 6 | Adicionar solvente até quase atingir a marca de volume |
| 7 | Agitar a solução vigorosamente usando um bastão de vidro ou agitador magnético |
| 8 | Adicionar solvente restante até atingir exatamente a marca de volume |
| 9 | Misturar bem a solução por inversão ou agitação |
Dicas para Preparação Precisa
- Use equipamentos limpos e calibrados.
- Pese o soluto com precisão.
- Use um solvente puro e de qualidade analítica.
- Agite a solução vigorosamente para garantir a dissolução completa.
- Evite tocar no gargalo do frasco volumétrico ou da pipeta.
- Se necessário, filtre a solução para remover quaisquer partículas não dissolvidas.
Aplicações das Soluções

As soluções têm uma ampla gama de aplicações em nossa vida cotidiana e na indústria. Elas são essenciais para diversos processos e produtos que usamos diariamente.
Na Vida Cotidiana, Assinale A Alternativa Que Contém Exemplo De Soluções
*
-*Produtos de limpeza
Sabões, detergentes e limpadores são soluções que removem sujeira e germes de superfícies.
-
-*Medicamentos
A maioria dos medicamentos é administrada na forma de soluções, como xaropes, injeções e colírios.
-*Bebidas
Sucos, refrigerantes e outras bebidas são soluções de açúcares, sais e outros ingredientes dissolvidos em água.
-*Produtos de higiene pessoal
Xampus, condicionadores e cremes dentais são soluções que limpam, condicionam e protegem o cabelo e os dentes.
Na Indústria
*
-*Produção de alimentos
Soluções são usadas para conservar alimentos (por exemplo, salmoura para picles), melhorar o sabor (por exemplo, marinadas para carnes) e processar alimentos (por exemplo, leite pasteurizado).
-
-*Indústria química
Soluções são usadas como reagentes em sínteses químicas, como solventes para dissolver outras substâncias e como catalisadores para acelerar reações.
-*Construção
Cimento, argamassa e concreto são soluções que são usadas para construir estruturas e pavimentar estradas.
-*Tratamento de água
Soluções são usadas para purificar água, remover impurezas e torná-la potável.
O uso de soluções tem um impacto significativo na sociedade, melhorando a saúde, a higiene, a produção de alimentos e o desenvolvimento industrial. Elas são essenciais para nossa vida moderna e continuam a desempenhar um papel vital em vários aspectos da nossa existência.
Em suma, Assinale a Alternativa que Contém Exemplo de Soluções oferece uma compreensão abrangente do conceito de soluções, capacitando os leitores a entender seus princípios fundamentais, propriedades e aplicações práticas. Este conhecimento aprimorado permite uma apreciação mais profunda do papel vital que as soluções desempenham em nossas vidas diárias e no avanço científico e tecnológico.
Quick FAQs
O que são soluções?
Soluções são misturas homogêneas de duas ou mais substâncias nas quais os componentes estão distribuídos uniformemente em nível molecular.
Quais são os diferentes tipos de soluções?
Existem vários tipos de soluções, incluindo soluções saturadas, insaturadas e supersaturadas, que diferem em sua capacidade de dissolver soluto.
Como calcular a concentração de uma solução?
A concentração de uma solução pode ser calculada usando várias unidades, como molaridade (M), molalidade (m) e porcentagem em massa (% m/m).

